望石智慧入选 AI4LS 权威蓝皮书!以 3D 分子生成大模型引领小分子生成式 AI 时代
关于AI for Life Science,一份重磅报告刚刚出炉!
10月30日,弗若斯特沙利文发布《2025中国AI4LS行业发展蓝皮书》,全景式、深层次地展现了AI for Life Science的发展历程、驱动因素、场景应用与未来趋势。
蓝皮书指出,在经历了经验科学、理论科学、计算科学、数据密集型科学的前四大范式之后,在AI的加持下,当前的科学研究正向第五范式——以AI为核心的智能化科研方向进化。
截至2024年,中国AI4S市场规模已达47亿元,涵盖药物研发、合成生物学、基因测序、材料开发及电池与储能等核心领域,从中长期发展来看,A14S市场规模有望突破千亿元体量。
其中,生命科学凭借深厚的数据基础、高问题复杂度与广阔的应用前景,正逐步成为AI4S最理想的应用场景之一。
蓝皮书指出,不同类型企业围绕平台构建、模型驱动与落地能力展开多元探索,代表性公司通过差异化技术路径和应用模式,正在推动AI从工具向赋能主体的跃迁。
在药物研发场景下,成立于2018年的望石智慧,入选本次蓝皮书的代表性公司。
凭借人工智能药物研发底层理论的突破、药物研发数据的深度治理、药物研发行业的沉淀认知和强大的软件与工程能力,望石智慧搭建了以多模态AI 3D分子生成大模型为核心的基座平台MolVado,该平台能够精准地生成与靶点口袋结构契合的分子或分子骨架,并通过系列计算评估工具提升其湿实验活性的概率。
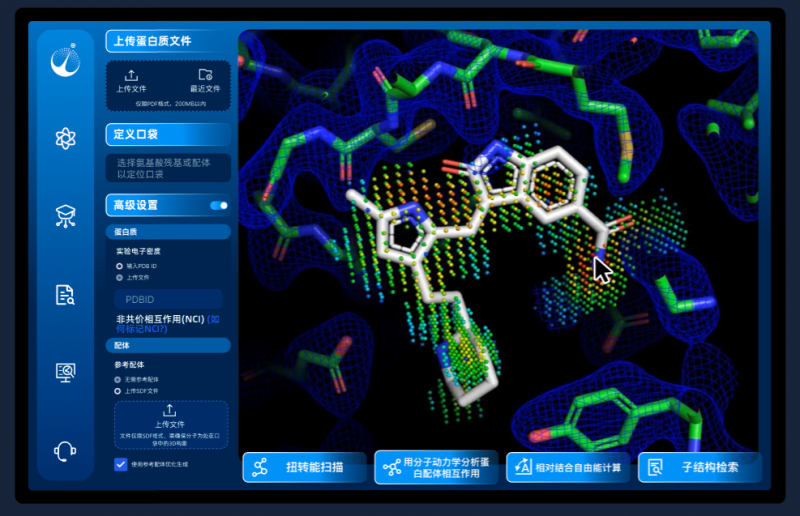
图:多模态AI 3D分子生成大模型基座MolVado平台示意图
公司的分子生成模型还可作为基座模型,合作伙伴能够在此基础上,充分整合自身拥有的数据、认知以及模型等要素,进行定制化迭代。目前,已有近百家药企、科研机构客户日常使用。
技术的可行性已在实践中得到充分验证:国内某头部创新药企借助MolVado平台,仅3个月通过10轮生成便获得全新骨架百纳摩尔级别活性分子,相较传统模式早期药物发现1-3年的周期大幅缩短,早期合成与实验验证成本更是降低了80%。
依托该模型,公司内部自研管线已收获显著成果,其中最快的管线已进入临床一期,同时基于生成式AI模型衍生出的实体库CRO业务,也在海内外积极扩展中。
以望石智慧为代表的AI药物研发公司,正以底层技术创新和规模化应用案例,生动诠释着AI for life Science的范式变革引发的历史级产业机遇。
长远来看,生命科学将直接受益于AI,催生出一批具有全球影响力的中国企业。促成从基础研究到临床转化的全面加速。
AI重构分子宇宙,药物研发迈入“生成”时代
在现代医学的版图中,小分子药物始终占据着不可撼动的核心地位。
尽管生物制剂、细胞疗法等新兴技术不断涌现,小分子药物凭借其良好的细胞膜穿透能力、口服生物利用度高、稳定性强、便于储存和服用等优势,依然是临床治疗的主流选择。
数据显示,在过去五到六年中,美国FDA批准的新药中,小分子药物占比高达70%。而放眼全球生物医药产业,小分子类药物总量仍占据近90%的份额。
然而,这一看似成熟的领域正面临深刻的结构性挑战。
随着疾病靶点的日益复杂,传统研发模式尽显疲态,其根本瓶颈在于——高度依赖经验与直觉的筛选方式,不仅效率低下,更从根本上限制了人类对广阔化学空间的探索能力。
小分子药物发现的本质,是在一个极其庞大的化学空间中寻找极少数具备理想药理活性、安全性和可开发性的分子,其可能的数量级估计高达10⁶⁰个——这是一个远超人类直观认知的数字。

然而,常用的研发手段,如高通量筛选(HTS)和基于已知骨架的结构优化,每周仅能测试几十到数百种化合物。即便结合虚拟筛选技术,人类实际探索的化学空间还不到总量的十亿分之一(0.000000001%)。
这也就使得现有的小分子研发几乎完全依赖于“已知”区域的微小优化,局限于人在药物设计中的思维框架和固有认知,而对绝大多数未知领域视而不见。
正是在这样的背景下,生成式AI成为突破化学空间探索瓶颈的关键力量,通过学习海量已知分子的结构与性质数据,捕捉潜在的物理化学规律与生物活性关联,在化学空间中智能导航,预测和生成具有特定属性的全新分子,重新定义药物发现的边界。
近期,一系列前沿模型相继发布,在实际应用中展现出惊人效率,成为AI赋能药物研发的有力证明。
Chai-2作为生成式AI从头设计蛋白质的里程碑,具备“零样本”设计能力——即使面对毫无实验数据的未知靶点,也能直接生成具有结合活性的新抗体。
实验显示,Chai-2从头设计抗体的平均成功率高达15.5%,相较此前仅0.1%的成功率,实现了百倍提升。
由麻省理工学院与Recursion联合推出的Boltz-2,则在亲和力预测方面树立新标杆,成为接近基于物理的自由能扰动(FEP)的深度学习模型,且速度提升1000倍。
研究人员可对分子进行大规模、高精度的虚拟筛选,通过干实验模拟进行快速试错,大幅压缩无效湿实验,降低研发成本与周期。
而在小分子领域,中国团队的布局更早,并且已经有突破性成果落地。
早在2020年底,望石智慧便针对基于配体(ligand-based) 的药物发现场景,发布了首代以骨架跃迁和衍生为主的2D生成模型AI Scaffold。
模型在分子新颖性方面表现突出,已助力多家国内外药企在BIC项目中实现专利突破与研发提速,奠定了其在AI分子设计领域的先发优势。
2022年,望石研究团队实现关键跃迁,首次提出基于实验电子密度的3D分子生成技术,并发布3D分子生成模型v1.0,创新性地优化了分子与蛋白口袋之间的形状互补性与相互作用模式,显著提升了生成分子的成药潜力,已成功加速多个FIC药物项目的研发进程。
2024年,望石智慧在《Nature Machine Intelligence》发表重磅研究成果,正式推出Lingo3DMol。

图:望石智慧在《Nature Machine Intelligence》发表重磅研究成果
与业内普遍基于图神经网络(GNN)技术路线不同,Lingo3DMol创新性地融合了语言模型与几何深度学习,在活性分子复现率、分子-口袋结合打分、分子构象等关键指标上表现更加出色。
如今,望石智慧正式推出多模态AI 3D分子生成基座大模型MolVado平台,能够深度解析靶点口袋三维构象,结合参考分子关键片段特征,快速生成百万级化合物库;并支持自定义参数配置,精准合成含指定结构的靶向分子。
传统药物研发需要合成数百个分子进行验证,望石智慧通过AI生成及构象验证后可以减少至20-50个;合成及实验验证成本降低约70%~80%。
平台将全新骨架Hit的发现周期从过去的1-3年压缩到了1-6个月以内,能快速生成结构新颖并契合口袋的分子。
实践表明,MolVado能够显著突破传统研究样本数量瓶颈,大幅缩短分子设计时间,实现高效、精准的药物设计,具备与Chai-2、Boltz-2等国际顶尖模型相媲美的颠覆性潜力。
某种意义上来说,我们越来越逼近小分子研发的终极愿景:只需描述想要的分子功能或靶点,AI 便能生成一批极有可能“命中”的分子设计,且这些设计在实验中真实有效,实现“设计即发现”。
未来的小分子药物研发,将不再是“筛选更多”,而是“生成更好”。
这场由AI驱动的范式革命,正在彻底重塑新药研发的未来图景——在那片广袤无垠的化学宇宙中,下一个重磅药物或许正等待被AI从头设计出来。
巨头集体押注,AI改写小分子药物游戏规则
众多迹象表明,AI小分子药物研发正迈向一个关键的拐点,成为药物创新的核心引擎。
大型药企通过战略调整与合作等方式,加大对AI的投入;投资机构也在押注巨额资金,支持该领域关键技术与生态的发展。
例如,由诺贝尔化学奖得主Demis Hassabis创办的Isomorphic Labs,不仅完成6亿美元的巨额融资,在与诺华合作中,双方开发针对三个未公开靶点的小分子疗法,合作总价值为12亿美元。

图:Demis Hassabis因其在AI蛋白质领域的贡献获得2024年诺贝尔化学奖
早在几年前,跨国医药巨头阿斯利康就曾表示,其一半的小分子开发项目正在使用AI深度辅助研发。今年6月,阿斯利康与石药集团达成重磅合作,总金额高达50亿美元,双方将依托石药集团的AI药物发现平台,涉及多个靶点的分子候选药物。
国内医药巨头也在积极布局,恒瑞医药组建了计算化学和AI辅助药物设计(AIDD)团队及平台,利用AI进行靶点发现、化合物虚拟筛选、分子结构优化、以及临床试验方案优化等领域。
复星医药和业内多家AI制药公司达成深度合作,中国生物制药则通过自主建设AI—PROTAC药物设计平台,首个血液瘤项目已获批进入临床。
这些动作都释放出一个明确信号:AI小分子研发的产业价值正在被主流药企认可,整个制药工业正接纳并拥抱AI,希望为行业带来更快更好的药物。
尽管生物制剂近年来蓬勃发展,小分子药物始终是制药产业的基石。数据显示,2024年全球畅销药物TOP100榜单中,小分子以42款药物拿下近半壁江山。
小分子药具备口服便捷、合成成本低、作用靶点灵活广泛等优势,良好的患者依从性,让其依旧是最具普适性的治疗手段之一。
此外,小分子药物在传统化学药物基础上,通过分子胶、PROTAC(靶向蛋白降解嵌合体)等技术突破“不可成药”靶点,带来了新的想象力空间。
数据显示,2024年小分子药物发现市场规模估计为569亿美元,预计到 2029年将达到 867亿美元,还在以 8.76% 的复合年增长率增长。
不仅如此,AI在小分子药物研发中的应用早已超越了传统化学药的范畴,正在分子胶、ADC(抗体偶联药物)、PROTAC、以及细胞治疗和基因治疗中的小分子组件等前沿领域扮演着革命性角色,市场前景广阔。
望石智慧以多模态3D分子生成大模型为核心,并整合了整合上下游工具,有效提高药物设计的效率和质量。在该平台中,药物研发人员可以像ChatGPT一样与模型交互,还能根据需求开发整合历史项目数据,帮助研发人员突破设计瓶颈。
而针对行业普遍存在的两大痛点,不类药分子“刷分”现象和无法真实评价分子的难题,望石智慧首创了“阶梯式评估机制”与“活性分子复现验证”的策略,有效提升了生成分子的成药可行性。
如今,该小分子药物发现解决方案已经有近百家药企使用,并且受到了海内外医疗机构的认可,包括齐鲁制药、深圳微芯生物、泰德制药、齐鲁锐格、贝勒医学院,英国癌症研究中心、清华大学、复旦大学医学院等。

图:北大医学——望石智慧AI生物医药数据技术协同创新联合实验室正式挂牌
这些行业案例证明,AI小分子生成已经从实验室概念走向了产业级应用,真正能够为合作方带来可衡量的研发加速和商业价值。
更值得关注的是,AI小分子平台不仅仅停留外部赋能上,也在内部管线上也取得了突破性进展,证明公司具备了从早期研发到临床落地的全流程能力。
今年上半年,首个根据AI平台设计并优化的造血祖细胞激酶1(HPK1)小分子抑制剂SWA1211片完成首例患者给药,成功进入针对晚期实体瘤的Ⅰ期临床研究。
该药物展现出与传统研发路径差异化的优势,不仅具有全新的骨架,还具有比同类项目更优的活性和选择性。
此外,以分子生成功能为基石,望石智慧正在从小分子生成能力延展到分子胶、多肽、共价化合物、环肽、RDC等新兴领域。
通过“对外合作+内部管线”的双轮驱动模式,望石智慧AI分子生成平台正在从工具转变为药物研发的核心引擎。
一系列案例证明,AI小分子生成已经从实验室概念走向了产业级应用,真正能够为合作方带来可衡量的研发加速和商业价值。作为行业的领先者,望石智慧打通了AI驱动从分子设计到验证的完整工业级解决方案,成为塑造未来生物医药格局的关键力量。
AI分子生成重塑行业,中国力量崛起
创新药研发长期以来属于“科学”范畴,高度依赖研究人员的经验与灵感;而AI的深度赋能,正推动这一领域向工程化范式跃迁——从偶发突破走向系统化、可重复、可规模化交付的新时代。
正如英伟达创始人、CEO黄仁勋所洞察的:“在人类历史上,生物学第一次有机会成为一门工程学,而不是科学。”
而在这个历史性的过程中,融合了物理现实的AI正在为药物研发构建强大的技术基座:它高精度地建模分子构象、靶点口袋、相互作用力场,并实现自动化打分与优化,将假设快速转化为可验证的分子实体。
未来,分子生成平台对药物创新的作用,将会像GPU对AI的作用一样,谁能够访问更好的基础平台,谁就能加速开发进度,更好地布局新的疾病领域和研发管线,这将从底层重构研发流程、成本结构与价值分配逻辑。
传统药物研发依赖高通量实验,本质上是一种“大海捞针”式的被动筛选,而AI分子生成技术通过对10^60化学空间的充分探索,能够直接从靶点信息或所需功能出发,设计出具有特定性质的全新分子结构,实现“按需定制”式的主动创造。
尤其对于小分子而言,其合成周期更长、实验验证试错成本更高,而如果从干实验计算模拟入手,实现研发流程的前置优化和质量控制,这种效率的提升直接体现在大幅压缩早期探索的时间和成本。
这一转变催生了全新的商业价值模式:过去,一个团队往往只具备特定垂直领域内的专利知识和能力,以药物专利(IP)为核心,如今,AI指向一个更具通用性的平台能力,不绑定特定靶点,不依赖特定假设,快速绕开专利壁垒生成具备IP潜力的全新分子。
这意味着,未来行业的价值锚点,不再仅属于最终上市的药物,更在于能持续产出优质分子的平台本身。一个经过充分验证的分子生成平台,本身就是可复用、可扩展的资产,就是护城河。
当然,也必须清醒认识到:尽管AI在蛋白质设计、抗体优化等领域已取得显著成果,小分子的从头设计(de novo design)仍处于实践意义上的早期阶段,其工程化成熟度远低于蛋白质领域。
而挑战越大,护城河越深;门槛越高,先发者优势越不可撼动。小分子生成平台的价值重估,才刚刚拉开序幕——它所承载的,远不止是效率提升或成本压缩,而是底层研发范式的颠覆以及整个创新药价值链的重构。
这一潜力,尚未被市场充分认知,更未被定价。真正的价值爆发,还在前方。
当前AI小分子领域,海内外已涌现多位领军者并形成不同的竞争优势,值得行业关注。
Isomorphic Labs核心人员源自DeepMind生命科学团队,并由2024年诺贝尔化学奖得主Demis Hassabis领导。
基于AlphaFold2的开创性成果,这一世界级团队正在迅速实现AI底层算法迭代。公司打造的新一代研发模型AlphaFold3,正在大规模预测蛋白质与配体的相互作用方式,特别是小分子结合的准确性,从而更快地找到有潜力的先导化合物。近期,公司由AI设计的抗癌药物即将启动人体试验,成为验证这一平台的关键性里程碑事件。
不止如此,强大的算法需要高质量的数据喂养,才能发挥最大效用。Terray Therapeutics凭借其独特的、高质量的数据资产,在竞争中脱颖而出。
Terray Therapeutics由老牌化学计算公司薛定谔前高管创办,通过其专有的高通量实验平台,Terray 构建了世界上最大的化学数据集,大约是所有公开化学数据总数的50倍。
该公司平台价值已被行业巨头认可,Terray 不仅获得了全球AI霸主英伟达的多轮投资,还和医药巨头百时美施贵宝(BMS)达成深度合作,共同开发小分子疗法。
国内企业中,望石智慧凭借顶尖算法模型和优质数据资产,代表中国AI小分子领域的领先水平。
经过8年技术沉淀,望石智慧成功打造了差异化工业级分子生成大模型。通过深度数据治理与自动化生成等方式,每周约处理2TB高质量数据,集成覆盖理化性质、亲和力、体外生物活性、ADME及安全毒理的多维度信息,为AI药物发现提供高质量的数据基础。
基于对分子设计的深入理解,望石智慧在强大的生成式AI模型基础上,构建一整套工业级小分子药物解决方案,融合生成式AI、CADD计算评估工具、化合物库及筛选服务构建干湿联动解决方案。
公司另一项独特优势在于,通过基座模型+定制化服务的方式,该平台能够利用企业历史项目数据与Know-How,降低入门成本并放大研发效率,形成企业独特竞争壁垒,并加速全新IP分子的生成。
更值得期待的是,医药大模型创新正在向 AI Agent(AI智能体)方向演进。围绕其生成式AI模型,望石智慧也在AI多智能体协作与多源知识增强层面展开深入布局,实现更高效的人机协同,加快推动候选分子向临床药物的转化。
由此来看,未来AI小分子药物研发的机遇将属于那些拥有卓越算法模型、高质量数据,并能将其转化为工业级解决方案的公司,这些公司将从根本上改变新药研发的范式。
写在最后
当前,中国已经是全球药物创新的关键力量。
中国创新药领域lisence-out交易不断被刷新,据统计2025上半年出海交易达72笔,总金额合计高达484亿美元。全球医药交易TOP10中,中国创新药资产贡献率超80%。
这背后是中国企业基于研发成本和速度优势,参与全球医药价值再分配。AI驱动的新药研发模式,正在成为这一趋势的核心引擎。
其中,以望石智慧为代表的中国公司,有望凭借强大的AI分子生成能力和工程化优势,打通早期研发到临床转化的全流程,向全球提供源源不断的有效分子,助力新一代疗法突破。
这一愿景下,中国企业不再是医药研发的追随者和参与者,更有望引领行业变革。















